Subiect №6 «procese electrochimice“
Potențialele de electrod standard de metale. Formarea unui strat dublu electric și potențialul de electrod la interfața metal electrolit. ecuația Nernst.
Tipuri de electrozi. EMF celulelor galvanice și de lucru maximă. Potențialele redox. Direcție reacții redox.
Electroliza de soluții electrolitice și se topește. Ordinea de oxidare și de reducere la electrozi. Electroliza cu anod inert și solubil. legea lui Faraday. Eficiența actuală. potențial de expansiune. Supratensiunii.
Aplicarea practică a proceselor electrochimice în domeniu. Surse de energie electrică: galvanoelementy și baterii. Utilizarea electrolizei în domeniu. procesele catodică și anodică.
Există o relație foarte strânsă între fenomenele chimice și electrice, a studiat chimia, deoarece cele mai multe fenomene este de natură electrică. Astfel de evenimente includ, de exemplu, legarea hidrogenului, procesele de hidratare ionizare, asociere, complexarea și, în final, reacția de oxidare-reducere.
Cu toate acestea, toate aceste procese nu pot fi atribuite unui număr de electrochimice, deoarece acestea nu sunt însoțite de interconversiunea energiei electrice și chimice. De exemplu, dacă reacția redox este efectuată în aceeași soluție, sistemul nu produce lucrări electrice, deoarece curentul total din cauza transferului de electroni de agent reducător agentului de oxidare, este egal cu zero (datorită mișcării haotice a electronilor și a ionilor).
În cazul în care procesele catodice și anodice spațial divizate (așa cum sa făcut în celulă), apoi prin închiderea circuitului extern, electronii napravlennoeperemeschenie de la anod la catod (adică, curent electric) și soluție realizată mișcarea direcțională a ionilor de la catod la anod.
Astfel, pentru a include doar acele reacții redox electrochimice, care produc curent electric sau se produce sub influența unui curent electric. Primul tip de reacție se realizează în celule electrochimice - baterii miniaturale si baterii de mare putere pentru vehiculele electrice, pile de combustie cu hidrogen furniza spaceships electricitate - (în care energia reacție chimică este transformată în energie electrică), al doilea tip - în celulele electrolitice (la care energia electrică este convertită în chimic ).
Potențialele de electrod standard de metale.
In 1865 (adică cel puțin 4 ani înainte de descoperirea legii prin periodice DI Mendeleev) metale au fost clasificate în funcție de activitatea lor. Ea a făcut celebru om de știință român NN Beketov, care a studiat efectul diferitelor metale în acizi diluați și apă și a observat că se comportă cel mai activ metale alcaline. Unele dintre aceleași metale, cum ar fi Cu, Hg, Ag, Au, nu hidrogen a fost înlocuit din soluțiile acide, dimpotrivă - este ea însăși capabilă să deplaseze hidrogenul din mercurul metalic și sărurile de argint.
Rezultatul lucrărilor NN Beketova a fost numită o gamă cilindree de metale:
K, Na, Ca, Mg, Al, Mn, Zn, Fe, Ni, Sn, Pb, H2. Cu, Hg, Ag, Au.
Toate metalele, spre stânga, în acest rând de hidrogen stramuta hidrogen din acizi diluați.
Numele modern al seriei - „seria de tensiune electrochimică“, deoarece poziția fiecărui metal din această serie este determinată de potențialul așa-nazyvaemogoelektrodnogo.
Care este potențialul de electrod? Cum apare?
Recall suma potentsialomnazyvayut chtoelektricheskim corespunzătoare energiei care trebuie să fie cheltuite (și apoi potențial pozitiv) sau care pot fi obținute (și apoi potențial negativ) pentru transferul unei unități de electricitate de la infinit la un anumit punct.
Conform opiniilor actuale, nodurile rețelele cristaline ale metalelor sunt atomi și ioni și atomi neutri sunt foarte mici, majoritatea covârșitoare a particulelor sunt sub formă de ioni. Electronii, slujind legilor teoriei cuantice, se deplasează în domeniul sarcinilor pozitive, creând un fel de „gaz de electroni“. Astfel, există un metal echilibru dinamic, care poate fi exprimată prin ecuația.
Dacă placa de metal este scufundat în apă, apoi sub acțiunea polarizată cationii porțiilor moleculele de apă intră într-un lichid Me z + + MH2 O ↔ [Me (H2O) m] z +. în timp ce electronii rămân pe placa metalică, în care metalul care este încărcată negativ.
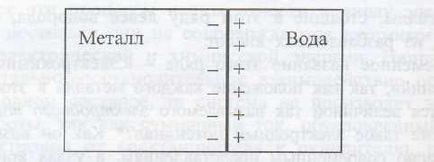
Cationii care au căzut în lichid, sunt dispuse în apropierea suprafeței unei plăci de metal încărcată negativ, formând astfel un strat dublu electric. care poate fi reprezentată schematic după cum urmează (Figura 1):
Fig.1. un strat dublu electric la metal apa
Astfel, la limita metalului lichid contactul electric cu modificări potentsialφrezko și nablyudaetsyaskachok (sau diferența) potentsialaΔφ care luate potențial nazyvatelektrodnym.
În cele mai multe literatura chimică contemporană notate prostoφ potențiale salturi.
În mod evident, mai activ metal, cu atât mai ușor va disocia atomi, cei mai mulți cationi merg în lichid și, prin urmare, va bόlshim sarcină negativă din metal, care, la rândul său, va provoca bόlshuyu diferența de potențial la interfața metal lichid.
Procesul de ioni metalici de tranziție în lichid este un proces reversibil. Prin urmare, în cazul în care placa de metal nu se scufundă în apă, și în soluția de sare de metal, echilibrul va fi mutat: metal în soluția va trece mai puțini ioni și diferența de potențial la metal soluția va fi puțin diferit decât în primul caz.
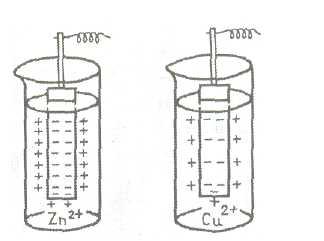
Fig. 2 este o diagramă de apariție a stratului dublu electric în cazul plăcilor de zinc și cupru, imersate în soluții de săruri ale acestora.
Fig.2. Schema potențialului de electrod
Se poate observa că valoarea potențialului electrodului este determinat în primul rând vsegoprirodoymetalla. De asemenea, aceasta depinde de temperatura, concentrația și alte faktorov1 soluție. Prin urmare, pentru a compara potențialul de electrod este necesar să se aleagă anumite condiții standard. In general, o comparație este efectuată la 25 ° C, o presiune de 101,3 kPa și la o concentrație în soluție de același nume ionul egal cu una (1 mol / l).
Astfel, potențialul de electrod standard, se numește potențialul de electrod al concentrației de ioni de metal de 1 mol / l.
Valoarea absolută a potențialului de electrod nu poate fi măsurată (de la introducerea oricăror sonde conduce inevitabil la apariția unui nou potențial diferență de contact). Cu toate acestea, nu există nici o dificultate otnositelnogoelektrodnogo de măsurare a capacității.
Potențialele relative electrozi metalici măsurate față de un potențial standard de electrod de hidrogen este luată în mod arbitrar ca fiind zero.
Deoarece hidrogen, la o temperatură de 298 K este un gaz din acesta imposibil ca o placă metalică pentru fabricarea. Ca din metal solid inert (de exemplu, Pt) este utilizat în electrodul standard de hidrogen.
Electrod hidrogen Structural (Fig.3) constă dintr-o placă de platină acoperită cu un strat de platină cu granulație fină - negru de platină, parțial scufundat în soluția acidă cu o concentrație de ioni de hidrogen de 1 mol / l. De obicei, ia acid non-volatil - SO4 H2 sulfuric sau HClO4 percloric. Plãcuþa servește hidrogen gazos pur, la o presiune constantă de 101,3 kPa.
Apariția capacității pe electrodul standard de hidrogen poate fi reprezentat după cum urmează. Gazul de hidrogen este adsorbit de platină intră în starea atomică, însă în stratul de suprafață de platină se echilibrează H2 ↔ 2H, dar la limita de platină și acid sulfuric - echilibru H ↔ H + + e.
Procesul totală este exprimată prin ecuația:
Astfel, electrodul de hidrogen poate fi desemnat ca H2 / H +, Pt. unde linia verticală indică interfața de fază.
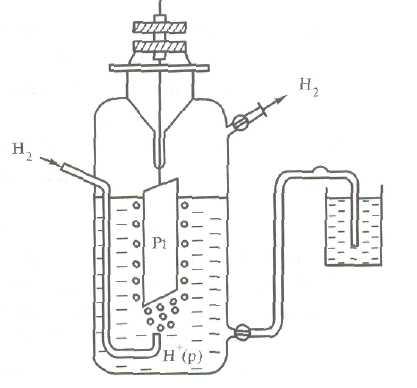
Fig. Electrod hidrogen 3. Schema sau așa
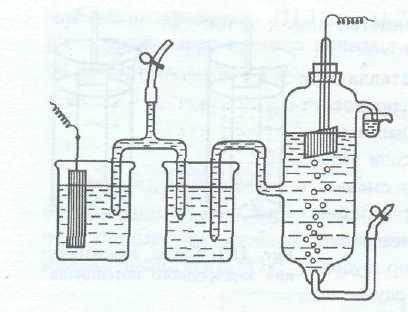
În cazul în care o placă metalică este cufundat într-o soluție de sare de concentrație a ionului metalic de 1 mol / l, pentru a conecta puntea electrolit cu un electrod de hidrogen (3), obținem celulei electrochimice. și anume curentul electric rezultat va merge sistemul. izuchaemogometalla raznostyuelektrodnyhpotentsialovvodorodnogoelektrodai datorate.
Faptul că această valoare - diferența de potențial de electrod anod și catod - în forța electromotoare deschis (deblocat) numite celule galvanice (emf sau E) a elementului:
În elementul zamknutomgalvanicheskom. și anume când valoarea măsurată a curentului în elementul (adică, atunci când compusul metalic platină cu unele conductor metalic), diferența de potențial dintre catod și anod de tensiune se numește:
Măsurarea directă a diferenței de potențial la bornele celulei electrochimice cu ajutorul unui voltmetru convențional poate obține valoarea tensiunii U, care nu este egal cu elementul CEM, adică U<ЭДС.
Diferența dintre forța electromotoare și tensiunea din cauza căderii de tensiune din interiorul elementului prin trecerea unui curent (in EMF fizica = I · R + I · rvnutr .. unde rvnutr - Când rezistența internă a electrozilor I.
0 produs I · rvnutr .. = 0, dar expresia R I · deși foarte mici, dar cu toate acestea, este încă și EMF). Prin urmare, măsurarea metodei de compensare emf efectuate de obicei, în care curge curentul prin elementul este aproape de zero. O metodă mai simplă și mai puțin precisă pentru măsurarea electromotoare este o măsurare directă a tensiunii terminale a celulei electrochimice cu un voltmetru având o înaltă rezistivitate (voltmetru mare ohmic). Din cauza diferenței de înaltă rezistență voltmetru de curent care curge prin elementul de mic, deci nu de mult între forța electromotoare și tensiunea celulei.
EMF circuitul de masura compus dintr-un electrod standard de hidrogen și potențialul de electrod standard a acesteia din urmă elektrodayavlyaetsya metal.
Dacă măsurăm potențialele de electrod standard de diferite metale în raport cu potențialul standard de electrod de hidrogen și să le aranjați în ordine crescătoare, atunci obținem un număr de metale tensiuni:
Mai multe stres caracterizează proprietățile chimice ale metalelor:
Dimensiunea mai mică a φ0 algebrică are metal, deci este activ chimic. și anume mai mare rezistența.
Distanțați mai departe într-o serie de stres două metal, forța electromotoare bόlshuyu va fi construit din aceste celule electrochimice, în care catodul va fi întotdeauna potențialul electrodului este mai mare.