Termodinamica procesului - studopediya
procese termodinamice din gazele ideale
Termodinamica analizează cinci procese principale de gaze ideale:
1. Helmholtz. (V = const) care apar la un volum constant de gaz;
2. Gibbs, (p = const) care apar la presiune constantă;
3. izoterme (T = const) care provine de la o constantă tempera-rotund;
4. adiabatic. (Q = 0), care curge fără alimentarea sau îndepărtarea căldurii, adică, care curge fără schimb de căldură cu mediul înconjurător;
5. politropic - proces de sinteză de schimbare a parametrilor fluidului de lucru cu schimb de căldură; pentru procesul său de patru anterioare sunt cazuri speciale.
proces izocoră sau izocoră (din greaca veche. # 943; # 963; # 959; # 962; - „egal“, și # 967; # 974; # 961; # 959; # 962; - „spațiu, spațiu ocupat“) - este un proces termodinamic care are loc la volum constant. Pentru a implementa procesul izocoră într-un gaz sau lichid suficient pentru a încălzi (rece), o substanță într-un vas care nu schimbă procesul izocoră presiunea gazului ideală oboma.Pri este direct proporțională cu temperatura. În dreptul reală de gaz Charles nu se realizează.
În graficele reprezentate de linii, care sunt numite isochors. Pentru un gaz ideal, ele sunt drepte în toate diagramele care se leagă parametrii: T (temperatura), V (volum) și P (presiune).
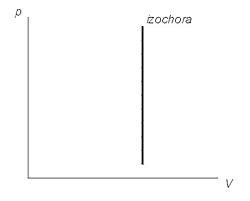
Diagrama Diagrama procesului izocoră (P, V)
Din definiția activității pe care o modificare în exploatare la procesul de izocoră este:
Pentru a determina performanța generală a procesului, vom integra această expresie. Având în vedere că volumul este neschimbat, atunci:
Cu toate acestea, un astfel integral este zero. Deci, atunci când gazul de proces izocoră nu funcționează:
Grafic, este mult mai ușor de dovedit. Din punct de vedere matematic, procesul de lucru - este aria de sub grafic. Dar procesul izocoră program este perpendicular pe axa x. Astfel, aria de sub ea este energia internă nulyu.Izmenenie a unui gaz ideal poate fi găsit de formula:
unde i - numărul de grade de libertate, care depinde de numărul de atomi din molecula (pentru monoatomic 3 (de exemplu, neon), 5 până la diatomic (de exemplu, oxigen) și 6 pentru triatomic sau mai mult (de exemplu, o moleculă de vapori de apă)).
Definiția și căldura specifică a formula și formula pentru energia internă poate fi rescrisă ca:
unde - capacitatea calorică molară la volum constant.
Folosind prima lege a termodinamicii pot fi găsite atunci când cantitatea de căldură procesului izocoră:
Dar gazul de proces izocoră nu face lucrarea. Adică, următoarea ecuație:
că este, toată căldura, care primește gaze naturale se duce la o schimbare în energia sa internă.