Sistemul de referință entalpie
metode termodinamice este imposibil de a găsi valorile absolute ale entalpiei și energiei interne, și poate fi determinată numai pentru a le modifica. În același timp, calculele termodinamice ale sistemelor reactive chimic este convenabil să se utilizeze un singur sistem de referință. Aici, din moment ce entalpia și energia internă sunt interdependente. este suficient să se introducă un sistem de referință pentru unul dintre entalpia. De asemenea, pentru comparație și ordonarea efectelor termice ale reacțiilor chimice care depind de starea fizică a reactanților și percolarea condițiilor XP, conceptul de stat standard a materiei. În conformitate cu recomandarea Comisiei privind termodinamica Uniunii Internaționale de Chimie Pură și Aplicată (IUPAC) în 1975, statul standard, este definită după cum urmează:
„Condiția standard este o condiție pentru gazele gaz ideal ipotetic la o presiune de 1 atmosfera fizică (101325 Pa). Pentru solide și lichide starea standard este o stare de material cristalin lichid sau pur pur, respectiv la o atmosferă 1fizicheskuyu presiune. Pentru substanțele în soluții pentru stat ipotetic stat acceptat standardul în care entalpia molară a soluției (1 mol de substanță în 1 kg de solvent) ar fi egal cu entalpia soluției la diluție infinită. Proprietățile substanțelor în condiții standard, desemnate de exponenți 0“. (Substanță numită substanță pură compusă din aceleași particule structurale (atomi, molecule etc.)).
Această definiție se spune că condițiile de gaz ipotetic și solut, deoarece în starea actuală a gazelor într-o măsură mai mare sau mai mică măsură diferită de idealul și starea de soluții - dintr-o soluție ideală. Prin urmare, atunci când se utilizează proprietățile termodinamice ale substanțelor în condiții standard sunt corectate la condițiile reale pe o deviere a acestor proprietăți de real. În cazul în care aceste abateri sunt mici, amendamentul nu poate intra.
Valorile de termodinamice directoarele sunt, de obicei, în condiții standard: presiunea p = 0 101325Pa și T0 = temperatura T0 = 0 K sau 298,15K (25 0 C). La crearea tabelelor de substanțe entalpii complet ca entalpia de referință a fost adoptat și starea lor standard, la o temperatură T0 = T0 = 0 K sau 298,15K.
Noi substanțe. elemente chimice pure sunt în stare de faza cea mai stabilă pentru p = 0 101325Pa și T0 temperatura entalpiile origine. ia entalpia valoarea zero. . (De exemplu, substanțele în stare gazoasă: O2 N2 H2 Cl2 F2 etc. pentru C (grafit) și metal (cristale solide) .....).
Pentru compușii chimici (CO2. H2O, etc.) și pentru substanțele care, fiind elemente chimice pure, care nu sunt în stare mai stabilă (O, N și colab.) Entalpie când p = 0 și 101325Pa T0ne zero. .
Entalpia compușilor chimici când p 0 și T0 este setat egal cu efectul termic al formării elementelor chimice pure la acești parametri, adică . De exemplu, la T0 = 0 K: și T0 = 298,15K :.
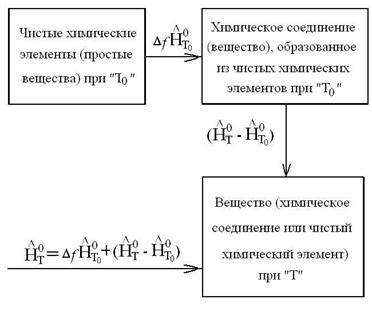
Entalpia oricărei substanțe la o temperatură T este egală cu cantitatea de căldură care este necesară pentru a aduce în procesul izobară pentru a curăța elemente chimice la o T0 temperatură pentru a primi substanța și se încălzește la T0 temperatură, adică temperatura T. Formula de calcul a entalpiei oricărei substanțe are forma:
. sau avem la inregistrare mai flexibil:
unde SuperScript „o“ indică faptul că substanța este în stare standard la p = 0 101325Pa; - formarea entalpie a substanței la T0 temperatura elementelor chimice pure; = - excesul de entalpie asociat cu capacitatea calorică a substanței, - entalpia totală, ținând seama de entalpia substanței.
Entalpia Schema la temperatura T poate fi reprezentat ca:
Referitor la diferitele substanțe individuale sunt prezentate cantități: și entalpia în exces pentru diferite temperaturi Tc.
Deoarece entalpia excesul substanțelor individuale din tabele nu sunt date, atunci partea stângă a expresiei pentru la T0 = 298,15K necesară pentru a adăuga și scade căldura materialului formării la o temperatură T0 = 0K. Apoi, vom obține excesul de entalpia. care este conținut în tabele, și termenul suplimentar. egală cu diferența în căldura de formare, la temperaturi T0 = 298K și T0 = 0 K; și anume . Apoi, avem:
Entalpia Full calculat folosind relații pentru T0 și T0 = 0 K = 298,15K au aceeași valoare numerică pentru substanța la o temperatură T. dată