echivalent chimic
Până la începutul secolului al XIX-lea a existat un progres dramatic in studiul metodelor cantitative de cercetare a substanțelor, care au condus la nouă schimbare fundamentală în știință, în general, și, în special, chimie.
Ruptura bruscă în studiul metodelor cantitative de materiale de cercetare la începutul secolului al XIX-lea a dus la o nouă schimbare fundamentală în domeniul științei în general și, în special, chimie.
După descoperirea legii lui Lavoisier de conservare a masei a fost urmată de o serie de noi legi cantitative - legi stoichiometrice.

În aer liber V.Rihterom lege a confirmat convingerile multor chimiști că compușii chimici care nu interacționează arbitrar, în proporții strict definite.
Partea teoretică
Conceptul de „echivalent chimic“
echivalent chimic al (E (C)) (în conformitate cu recomandările IUPAC) este o particulă condițional sau reală este egală sau un multiplu întreg al unității sale mai mici formula corespunzătoare *:
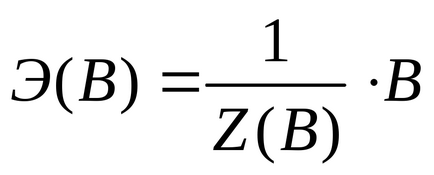
unde V - o unitate de substanțe care pot fi definite: particule de fapt existente, cum ar fi un atom (Cu, Na, C), molecula (N2 HCl, KOH, Al2 (SO4) 3 CO2 ..), anioni - cationi (OH SO4 2-.) (Cu 2+ K +.), radicalii (C2 H5 -NO2 -.), materiale condiționale cristaline molecule și polimeri, orice alt tip de particule;
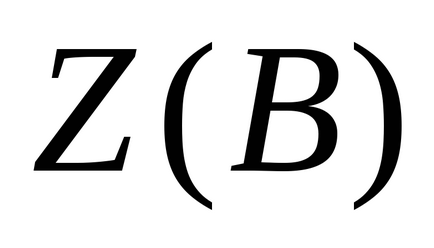
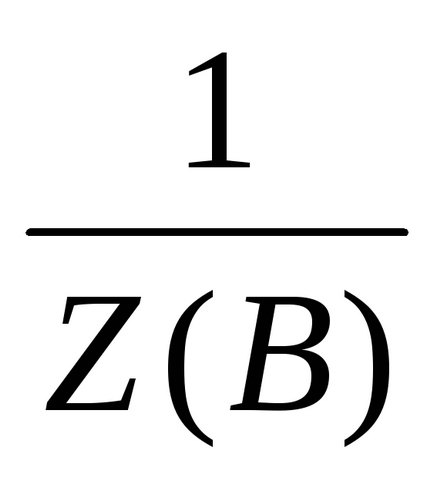
Utilizarea factorului de echivalență ca valoare fracționată mai puțin convenabil.
Numărul echivalent de Z este întotdeauna mai mare sau egal cu 1 și este adimensională; când Z = 1 corespunde substanței echivalente cu formula unității.
Calculul numărului echivalent de unități diferite formule este prezentată în Tabelul 1.1.
Cantitatile număr echivalent, și, în consecință, echivalentul depinde de reacția chimică în care a implicat substanța.
* Înțeles anterior cantitate echivalentă chimică a unei substanțe care se adaugă sau înlocuiește 1 mol de atomi de hidrogen în reacție. Cu toate acestea, acest termen se referă nu la echivalentul, ci la cantitatea de material echivalent.
Reacțiile de schimb. de exemplu, prin neutralizarea acidului fosforic echivalent cu numărul (echivalent) de acid variază în funcție de caracterul complet al reacției:
reacția H3 PO4 + 3KOH → K3 PO4 + 3H2O număr echivalent Z (H3 PO4) = = n (H +) = 3, deoarece reacția implică trei ioni de acid H + fosforic, și echivalentul H3 PO4 va fi o particulă noțional 1 / 3H3 PO4 (E (H3 PO4) = 1 / 3H3 PO4).
Tabelul 1.1. Calcularea chislaZveschestva echivalente.